Los hidróxidos son un grupo de compuestos químicos formados por un metal y uno o varios aniones hidroxilos, en lugar de oxígeno como sucede con los óxidos.
Arrhenius dijo que un hidróxido o base es aquella sustancia que va a liberar iones Hidroxilo.
Bronsted-Lowry dijo que un hidróxido o base es aquella sustancia que va a aceptar o recibir protones.
El hidróxido, combinación que deriva del agua por sustitución de uno de sus átomos de hidrógeno por un metal. Se denomina también hidróxido el grupo OH formado por un átomo de oxígeno y otro de hidrógeno, característico de las bases y de los alcoholes y fenoles.
Los hidróxidos se formulan escribiendo el metal seguido con la base de un hidruro del radical hidróxido; éste va entre paréntesis si el subíndice es mayor de uno. Se nombran utilizando la palabra hidróxido seguida del nombre del metal, con indicación de su valencia, si tuviera más de una. Por ejemplo, el Ni(OH)2 es el hidróxido de níquel (ii) y el Ca(OH)2 es el hidróxido de calcio (véase Nomenclatura química).
Las disoluciones acuosas de los hidróxidos tienen carácter básico, ya que éstos se disocian en el catión metálico y los iones hidróxido. Esto es así porque el enlace entre el metal y el grupo hidróxido es de tipo iónico, mientras que el enlace entre el oxígeno y el hidrógeno es covalente. Por ejemplo:
NaOH(aq) → Na+(aq) + OH-
Los hidróxidos resultan de la combinación de un óxido con el agua. Los hidróxidos también se conocen con el nombre de bases. Estos compuestos son sustancias que en solución producen iones hidroxilo.
En la clasificación mineralógica de Strunz se les suele englobar dentro del grupo de los óxidos, aunque hay bibliografías que los tratan como un grupo aparte.
Los hidróxidos se clasifican en: básicos, anfóteros y ácidos. Por ejemplo, el Zn(OH)2 es un hidróxido anfótero ya que:
con ácidos: Zn(OH)2 + 2H+ → Zn+2 + 2H2O
con bases: Zn(OH)2 + 2OH− → [Zn(OH)4]−2
miércoles, 2 de noviembre de 2016
NOMENCLATURA
NOMENCLATURA:
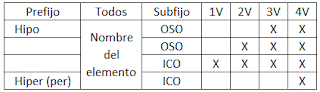
Las nomenclaturas más utilizadas son la estequiométrica y la de Stock, aunque tambien existe la tradicional pero está en desuso.
Estequiométrica o sistemática:
Se nombra intercambiando los términos de la fórmula (1º el oxígeno y 2º el elemento), para el oxígeno se utiliza el término óxido precedido de el prefijo numérico que le corresponde, debido a la cantidad de átomos que hay en el compuesto de dicho elemento, y para el elemento, su nombre precedido tambien por el prefijo numérico que le corresponde, unidos los 2 elementos por la particula "de".
Los prefijos son:
1. Mono
2. Di
3. Tri
4. Tetra
5. Penta
6. Hexa
7. Hepta
8. Octa
9. Nona
10. Deca
Ejemplos:
Fe2O3 Trioxido de dihierro.
FeO Óxido de hierro
STOCK:
Se nombra intercambiando los términos de la fórmula (1º el oxígeno y 2º el elemento), para el oxígeno se utiliza el término óxido, pero no se le precede de ningún prefijo, después se sitúa la partícula "de" y a continuación de pone el nombre del elemento, seguido, si es necesario, de su valencia en números romanos. Si dicho elemento no tiene más que una sola valencia, no es necesario ponerlo.
Ejemplos:
Fe2O3 Óxido de hierro (III)
FeO Oxido de hierro (II)
Na2O Oxido de sodio
Excepción: El oxígeno no forma óxido con el fluor, ya que éste es más electronegativo.
Tradicional:
En esta forma de nomenclatura consideramos sufijos prefijos que dependen de la cantidad de valencias que tenga el elemento con el que se forma el óxido.
Prefijo Sufijo Cantidad Valencias
Si es un oxido básico usamos la palabra Óxido seguido del prefijo, luego el nombre del elemento y terminamos con el sufijo.
Ejemplo: Para el cromo Cr que tiene valencias +2, +3, +6 tenemos:
CrO Óxido hipocromoso
Cr2O3 Óxido cromoso
CrO3 Óxido crómico
Para un oxido ácido usamos la palabra anhídrido en lugar de la palabra óxido
Ejemplo: Para el azufre S que tiene valencias +2, +4, +6 tenemos
SO Anhídrido hiposulfuroso
Las nomenclaturas más utilizadas son la estequiométrica y la de Stock, aunque tambien existe la tradicional pero está en desuso.
Estequiométrica o sistemática:
Se nombra intercambiando los términos de la fórmula (1º el oxígeno y 2º el elemento), para el oxígeno se utiliza el término óxido precedido de el prefijo numérico que le corresponde, debido a la cantidad de átomos que hay en el compuesto de dicho elemento, y para el elemento, su nombre precedido tambien por el prefijo numérico que le corresponde, unidos los 2 elementos por la particula "de".
Los prefijos son:
1. Mono
2. Di
3. Tri
4. Tetra
5. Penta
6. Hexa
7. Hepta
8. Octa
9. Nona
10. Deca
Ejemplos:
Fe2O3 Trioxido de dihierro.
FeO Óxido de hierro
STOCK:
Se nombra intercambiando los términos de la fórmula (1º el oxígeno y 2º el elemento), para el oxígeno se utiliza el término óxido, pero no se le precede de ningún prefijo, después se sitúa la partícula "de" y a continuación de pone el nombre del elemento, seguido, si es necesario, de su valencia en números romanos. Si dicho elemento no tiene más que una sola valencia, no es necesario ponerlo.
Ejemplos:
Fe2O3 Óxido de hierro (III)
FeO Oxido de hierro (II)
Na2O Oxido de sodio
Excepción: El oxígeno no forma óxido con el fluor, ya que éste es más electronegativo.
Tradicional:
En esta forma de nomenclatura consideramos sufijos prefijos que dependen de la cantidad de valencias que tenga el elemento con el que se forma el óxido.
Prefijo Sufijo Cantidad Valencias
Si es un oxido básico usamos la palabra Óxido seguido del prefijo, luego el nombre del elemento y terminamos con el sufijo.
Ejemplo: Para el cromo Cr que tiene valencias +2, +3, +6 tenemos:
CrO Óxido hipocromoso
Cr2O3 Óxido cromoso
CrO3 Óxido crómico
Para un oxido ácido usamos la palabra anhídrido en lugar de la palabra óxido
Ejemplo: Para el azufre S que tiene valencias +2, +4, +6 tenemos
SO Anhídrido hiposulfuroso
OXIDOS
El Oxido es un compuesto inorgánico que se forma al unir algún elemento químico con Oxígeno. Los óxidos se clasifican en dos grupos: Óxidos Básicos y Óxidos Ácidos.
Los óxidos son compuestos binarios formados por la combinación del oxígeno con un elemento químico.
El oxígeno actúa con su número de oxidación (-2), mientras el otro elemento actúa con un número de oxidación positivo.
La fórmula se obtiene al intercambiar las valencias de dichos elementos.
X2On
Donde:
X, es cualquier elemento químico
n, es la valencia de dicho compuesto químico
Ejemplos:
Fe2O3 Oxido con Hierro de valencia 3
FeO Oxido con Hierro de valencia 2
Ahora considerando el FeO, si es Hierro con valencia 2 el compuesto sería Fe2O2, pero los compuestos siempre hay que simplificarlos, así que se queda en FeO.
Un Óxido es básico si el elemento químico que se junta con el Oxígeno (O) es un metal.
Un Óxido es Ácido si el elemento químico que se junta con el oxígeno es un no metal.
Los óxidos son compuestos binarios formados por la combinación del oxígeno con un elemento químico.
El oxígeno actúa con su número de oxidación (-2), mientras el otro elemento actúa con un número de oxidación positivo.
La fórmula se obtiene al intercambiar las valencias de dichos elementos.
X2On
Donde:
X, es cualquier elemento químico
n, es la valencia de dicho compuesto químico
Ejemplos:
Fe2O3 Oxido con Hierro de valencia 3
FeO Oxido con Hierro de valencia 2
Ahora considerando el FeO, si es Hierro con valencia 2 el compuesto sería Fe2O2, pero los compuestos siempre hay que simplificarlos, así que se queda en FeO.
Un Óxido es básico si el elemento químico que se junta con el Oxígeno (O) es un metal.
Un Óxido es Ácido si el elemento químico que se junta con el oxígeno es un no metal.
Compuestos acidos y basicos
Los compuestos básicos son aquellos que liberan Hidróxidos en solución acuosa (OH-) y que tiene un potencial Hidrógeno (pH) entre 7 y 14. Siendo los más básicos los de pH alto. Los compuestos básicos se dice que ceden electrones.
Los compuestos ácidos son aquellos que liberan protones (H+) en solución acuosa y que tiene un pH entre 1 y 7. Por esto se dice que los ácidos ceden protones y tienden a aceptar electrones. Siendo los más ácidos los de pH bajo.
Los compuestos ácidos son aquellos que liberan protones (H+) en solución acuosa y que tiene un pH entre 1 y 7. Por esto se dice que los ácidos ceden protones y tienden a aceptar electrones. Siendo los más ácidos los de pH bajo.
Tabla periódica
La tabla periódica que separa a los elementos en tres
grupos: los metales (que aparecen en color verde), no metales (en color
naranja), y los metaloides (en color azul).
La mayoría de los elementos son metales. Generalmente son
brillantes, y sólo se derriten a altas temperaturas. Su forma puede cambiar
fácilmente .Los metales se corroen, al igual que el desgaste gradual del
hierro. El calor y la electricidad viajan fácilmente a través de los metales.
A la derecha de la Tabla Periódica aparecen los no metales.
Su superficie es opaca, y son malos conductores de calor y electricidad. En
comparación con los metales, son de baja densidad, y se derriten a bajas
temperaturas. La forma de los no metales no puede ser alterada fácilmente, ya
que tienden a ser frágiles y quebradizos.
A los elementos que tienen las propiedades de los metales y
no metales se les llama, metaloides. Pueden ser tanto brillantes como opacos, y
su forma puede cambiar fácilmente. Generalmente, los metaloides son conductores
de calor y de electricidad, de mejor manera que los no metales, y no tan bien
como los metales
Biosfera

la biosfera es una parte de la tierra donde habitan seres vivos. Es una capa delgada sobre la superficie del planeta,con una densidad y grosor irregular.Esta se ve afectada por la posición y los movimientos de la tierra en relación con el sol, y por los movimientos del agua y en aire en la superficie.Hay notables diferencias entre las superficies de los continentes; esto se refleje en las especies vegetales y animales que se encuentran en distintas regiones de la biosfera.
La biosfera se extiende aproximadamente entre unos 8 a 10 km por encima del nivel del mar y varios metros por abajo del nivel del suelo,hasta donde pueden penetrar las raíces,pero persiste hasta mucho mas allá.
La biosfera ha permanecido lo suficientemente estable a lo largo
de cientos de millones de años para permitir la evolución de las formas de vida
que hoy conocemos. Sin embargo, ya se sabe que el conjunto de poblaciones
biológicas y su entorno físico conforman la biosfera, de modo que cualquier
efecto transformador repercutirá en el conjunto. La contaminación del aire, del
agua o del suelo, pone en peligro la estabilidad de los ecosistemas y por ende,
la vida en la biosfera.
Factores Ambientales
El ambiente y los seres vivos se encuentran e una mutua
relación.Pues el ambiente influye sobre los seres vivos y de la misma manera
estos influyen sobre el ambiente. Y la forma e la que ambos se influencia se ha
denominado factores ambientales o ecológicos.Su influencia en los seres vivos
es la suma de los factores ambientales,Estos factores determinan adaptaciones a
varias especies,y la distribución de estos sobre la tierra.
- Factores abióticos:son los aspectos físicos o químicos que afectan a los seres vivos.Los físicos son:la luz,la temperatura,altitud,latitud,clima,etc. Los químicos son: el suelo,el oxigeno,el dióxido de carbono,los nutrientes,etc. Varían según el ecosistema de cada ser vivo.
Algunas especies adaptaron
su conducta y unas de las adaptaciones son :
hibernación
estivación
diapausa
Factores químicos:Es la superficie sobre la cual se
establecen los seres vivos, y en la que llevan acabo varias funciones, como, de
nutrición, fijación, protección, etc. Aunque en el sustrato tiene importantes
efectos mecánicos sobre los organismos que viven sobre o dentro de el, son de mayor relevancia
sus aspectos químicos, sobre todo como fuente de minerales y nutrientes par los organismos.
1.Productores o Autótrofos, organismos capaces de fabricar o sintetizar su propio alimento a partir de sustancias inorgánicas como bióxido de carbono, agua y sales minerales.
- Factores bioticos:Son todos aquellos que tienen vida,sean organismos unicelulares u organismos pluricelulares, por ejemplo animales, vegetales y microorganismos.
1.Productores o Autótrofos, organismos capaces de fabricar o sintetizar su propio alimento a partir de sustancias inorgánicas como bióxido de carbono, agua y sales minerales.
Cadena Trófica
La cadena trófica es aquella que describe el proceso de transferencia de sustancias nutritivas a través de varias especificas de una comunidad biológica , en el cual cada uno se alimenta del procedente y es alimento del siguiente.Corriente de energía y nutrientes que se establece entre varias especies de un ecosistema.
Productores primarios, autógrafos, que utilizando la energía
solar (fotosíntesis) o reacciones químicas minerales obtienen
la energía necesaria para fabricar materia orgánica a partir de nutrientes
inorgánicos.
Consumidores, heterótrofos, que producen sus componentes a
partir de la materia orgánica procedente de otros seres vivos.
• Predadores: Organismos que ingieren el cuerpo de sus
presas, entero o en parte.
• Descomponedores y detritívoros. Los primeros son
organismos saprofitos, como bacterias y hongos, que aprovechan los residuos por
medio de digestión externa seguida de absorción. Los detritívoros son protistas
fotógrafos y pequeños animales, que devoran los restos en el suelo o en los
sedimentos del fondo
Según el número de términos que tengamos que contar desde el
principio de la cadena: consumidores primarios, consumidores secundarios y
consumidores terciarios.
• Consumidores primarios, los fitófagos o herbívoros. Devoran
a los organismos autótrofos, principalmente plantas o algas, se alimentan de
ellos de forma parásita, como las abejas
• Consumidores secundarios, los carnívoros, que se alimentan
directamente de consumidores primarios, pero también los parásitos de los
herbívoros, como por ejemplo el ácaro Varroa , que parasítica a las abejas
• Consumidores terciarios, los organismos que incluyen de
forma habitual consumidores secundarios en su fuente de alimento. Están los
animales dominantes en los ecosistemas, sobre los que influyen en una medida
muy superior a su contribución, siempre escasa, a la biomasa total. En el caso
de los grandes animales cazadores les corresponde ser llamados súper predadores
• Los descomponedores son las bacterias y hongos encargados
de consumir los últimos restos orgánicos de productores y consumidores muertos.
Su función es esencial, pues convierten la materia muerta en moléculas
inorgánicas simples. Ese material será absorbido otra vez por los productores,
y reciclado en la producción de materia orgánica. De esa forma se reanuda el
ciclo cerrado de la materia, estrechamente vinculado con el flujo de energía.
 |
| Ejemplos de una cadena trófica terrestre y marina |
Neutralizacion Acidos y Bases
Se llama neutralización a la reacción que se produce entre disoluciones
acidas y básicas. Todas estas reacciones dan como producto una sal y agua.
La ecuación general que representa este tipo de reacción es:
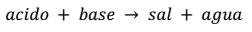
Los antiácidos contrarrestan la acidez estomacal, a través de una
reacción de neutralización.
Los antiácidos contrarrestan la acidez estomacal, a través de una
reacción de neutralización.
Por ejemplo, la reacción de neutralización que se produce entre el
ácido nítrico (HNO3) y el hidróxido de potasio (KOH) es:
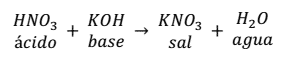
Como se puede observar en la reacción, la sal se forma entre el anión
() del ácido y el catión (K+).
Otra reacción de neutralización es la que se produce entre el ácido
sulfúrico y el hidróxido de sodio.
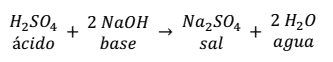
Como se puede observar en la reacción, la sal se forma entre el anión
() del ácido con 2 cationes (Na+) de la base, más 2 moléculas de agua.
La variación de entalpia (∆H) en las reacciones de neutralización entre
ácidos fuertes y bases fuertes, es siempre la misma.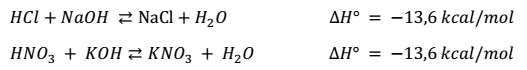
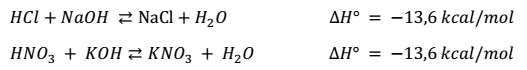
Ph y pOH
El PH mide las
concentraciones de los iones hidrionio, mientras que el POH mide las
concentraciones de los aniones hidroxilo o iones hidróxido. Los productos
químicos que usamos a DIARIO tienen un grado de acidez que podría ser peligroso.
Ph
El pH es una medida
de acidez o alcalinidad de una disolución. El pH
indica la concentración de iones hidrógeno [H]+ presentes en
determinadas disoluciones.
La sigla
significa: potencial hidrógeno o potencial de hidrogeniones,
quien lo definió en 1909 como el opuesto del logaritmo en
base 10 o el logaritmo negativo, de la actividad de
los iones hidrógeno.
pOH
En química, concretamente en el estudio de la
química ácido-base, se define el pOH como el logaritmo negativo en base 10 de la actividad de
los aniones hidróxilo , o también en términos de
concentración de éstos.

Ecosistema
Un ecosistema es el conjunto formado por los seres
vivos y los elementos no vivos del ambiente y la relación vital que se
establece entre ellos.
La ciencia encargada de estudiar los ecosistemas y
estas relaciones es la llamada ecología. Los ecosistemas pueden ser de dos tipos: terrestres (bosques,
selvas, sabanas, desiertos, polos, etc.) y acuáticos (comprenden
desde un charco hasta los océanos, mares, lagos, lagunas, manglares, arrecifes
coralinos, etc.).

La mayoría de los ecosistemas de nuestro planeta son
acuáticos ya que sus tres cuartas partes están cubiertas por agua. Sin
embargo, los ecosistemas terrestres son los más conocidos por
nosotros debido a que no requiere un equipo especial para su observación. Todo ecosistema se caracteriza por la presencia de componentes vivos o
bióticos (plantas, animales, bacterias, algas y hongos) y de
componentes no vivos o abióticos (luz, sombra, temperatura, agua, humedad,
aire, suelo, presión, viento y pH).

Las especies se dispersan en las
aéreas por las que se
extienden en poblaciones o demos, las cuales ocupan determinadas
posiciones en los ecosistemas, según requerimientos alimentarios, ambiente que
precisen, etc., posiciones que definen su nicho ecológico específico.
Para referirse a las características ambientales de un tipo de organismo dado,
se suele hablar de hábitat.
Un ecosistema es el conjunto formado por los seres vivos y los elementos no vivos del ambiente y la relación vital que se establece entre ellos.
La ciencia encargada de estudiar los ecosistemas y estas relaciones es la llamada ecología.

La mayoría de los ecosistemas de nuestro planeta son acuáticos ya que sus tres cuartas partes están cubiertas por agua. Sin embargo, los ecosistemas terrestres son los más conocidos por nosotros debido a que no requiere un equipo especial para su observación.

Las especies se dispersan en las
aéreas por las que se extienden en poblaciones o demos, las cuales ocupan determinadas posiciones en los ecosistemas, según requerimientos alimentarios, ambiente que precisen, etc., posiciones que definen su nicho ecológico específico. Para referirse a las características ambientales de un tipo de organismo dado, se suele hablar de hábitat.
Suscribirse a:
Comentarios (Atom)